انتشار مطالعه فاز سوم کارآزمایی بالینی واکسن پاستوکووک انستیتو پاستور
به گزارش گروه اجتماعی خبرگزاری دانشجو، مطالعه فاز سوم کارآزمایی بالینی واکسن پاستوکووک انستیتو پاستور ایران منتشر شد.
دکتر احسان مصطفوی، عضو هیات علمی انستیتو پاستور ایران و مدیر پروژه کارآزمایی بالینی واکسن کرونای مشترک ایران و کوبا (سوبرانا/پاستوکووک) روند انجام مطالعه کارآزمایی بالینی فاز ۳ واکسن کرونای مشترک انستیتو پاستور ایران و انستیتو فینلای کوبا را تشریح کرد.
چاپ و انتشار ۱۶ مقاله مرتبط با مراحل مختلف توسعه و مطالعات بالینی این واکسن
نتایج مطالعه کارآزمایی بالینی فاز ۳ واکسن کرونای مشترک انستیتو پاستور ایران و انستیتو فینلای کوبا (سوبرانا/پاستوکووک)، در شماره جدید مجله بین المللی JAMA Network Open منتشر شده است.
مجلات پزشکی جاما (JAMA network)، مجلاتی هستند که در حوزه پزشکی از سال ۱۸۸۳ از سوی انجمن پزشکی آمریکا منتشر میشوند. مجلات جاما یکی از مجلات پرمخاطب حوزه پزشکی به شمار میروند که دارای ۱۳ مجله اختصاصی هستند که JAMA Network Open یکی از آنها است. مجله JAMA Network Open از معتبرترین مجلات منتشر کننده کارآزمایی بالینی در دنیا میباشد.
تاکنون ۱۶ مقاله از مطالعات فازهای مختلف توسعه و مطالعات بالینی واکسنهای سوبرانا (پاستوکووک) منتشر شده است که، ۶ مقاله، از جمله مقاله اخیر، با مشارکت نویسندگان ایرانی و کوبایی بوده است.
مزایای واکسن پاستوکووک
واکسنهای سوبرانا ۲ و سوبرانا پلاس در انستیتو فینلای کوبا توسعه یافته و تولید شده است و با نامهای پاستوکووک و پاستوکووک پلاس در انستیتو پاستور ایران و پس از انتقال موفقیتآمیز فناوری تولید میشوند. این واکسن مجوز تزریق را در کشورهای ایران، کوبا، بلاروس، مکزیک، نیکاراگوئه، و ونزوئلا کسب کرده است.
سوبرانا (پاستوکووک)، یک واکسن بر پایه پروتئین نوترکیب است. با شروع پاندمی کووید ۱۹، که کشور با چالش تامین واکسن مواجه بود، مزیت بالقوه این واکسن، در تولید نسبتا سریع و مقرون به صرفه آن و پایداری آن در دمای ۲ تا ۸ درجه سانتیگراد، در کنار اثربخشی بالا و بی خطری آن، یک مزیت رقابتی خوب برای این واکسن فراهم کرد. خوشبختانه بر اساس مطالعات انجام شده، مجوز استفاده از این واکسن، به عنوان دز یادآور تمام واکسنهای کشور هم صادر شد و این واکسن، علاوه بر بزرگسالان، قابلیت تزریق به سنین ۵ تا ۱۸ سال را هم در کشور دارد.
نتایج واکسن از نظر اثربخشی و بی خطری در مطالعه اخیر
مطالعه فاز سوم بررسی اثربخشی و ایمنی واکسنهای سوبرانا و سوبرانا پلاس (پاستوکووک و پاستوکووک پلاس در ایران)، در بهار و تابستان سال ۱۴۰۰ در ۸ شهر کشور انجام شد. این مطالعه در بازه زمانیای صورت گرفت که سوش دلتا در کشور غالب بود که هم از نظر تاثیری که بر واکسنها میگذاشت و باعث افت تاثیرگذاری واکسنها میشد، مورد توجه بود و هم از این نظر که این واریانت منجر به بیماریزایی نسبتا شدید و بستری بالا میگردید.
در این مطالعه افراد ۱۸ تا ۸۰ سال داوطلب ایرانی مورد مطالعه قرار گرفتند. بر اساس طراحی مطالعه، تا ۳۰ درصد داوطلبان این مطالعه میتوانستند بیماری زمینهای داشته باشند، و اهمیت آن این بود که واکسن قرار بود در جمعیت عمومیای استفاده شود که درصدی از آنها مبتلا به بیماریهای زمینهای بودند و کارایی واکسن میتوانست در برابر بیماریهای زمینهای و در سنین و گروههای مختلف مورد ارزیابی قرار گیرد.
مطالعه در اردیبهشت ماه سال ۱۴۰۰ در شهر اصفهان آغاز شد. در شهریور ماه آن سال، کدگشایی مطالعه برای شش شهری که دو دز واکسن سوبرانا ۲ (پاستوکووک) را دریافت کرده بودند (شهرهای اصفهان، همدان، بندرعباس، کرمان، ساری و بابل)، انجام شد. درباره دو شهر یزد و زنجان نیز که سه دز از واکسن را دریافت کرده بودند (دو دز سوبرانا ۲ و یک دز سوبرانا پلاس) در مهر ماه ۱۴۰۰ کدگشایی انجام شد.
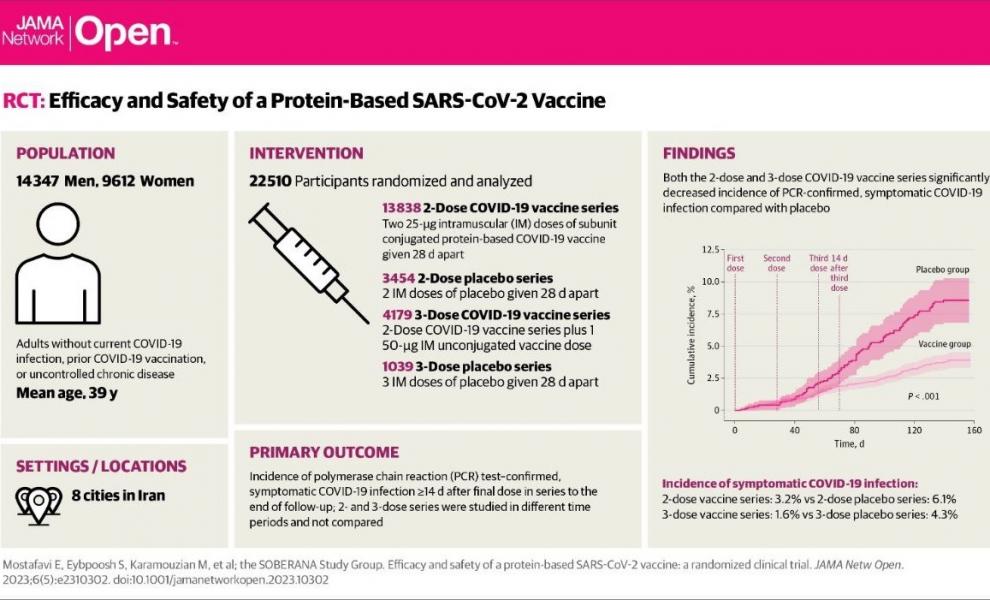
در این مرحله از کارآزمایی بالینی، ۲۳۹۵۹ نفر (۱۴۳۴۷ مرد و ۹۶۱۲ زن) وارد مطالعه شدند. میانگین سنی داوطلبین ۳۹ سال بود. حدود ۲۹ درصد داوطلبین دارای حداقل یک بیماری زمینهای بودند. ۷۱ درصد واریانت در گردش در تیرماه و ۹۵ درصد واریانت در گردش در مرداد ماه در افراد مبتلا به کووید ۱۹ شرکت کننده در این مطالعه، از واریانت دلتا بود.
در افرادی که در روز ورود به مطالعه، تیتر سرمی مثبت ناشی از ابتلای قبلی به کووید ۱۹ را نشان نداده بودند، افزایش چهار برابری تیتر سرمی در رژیم دو دزه در ۸۶ درصد افراد و در رژیم سه دزه در ۹۹ درصد افرادی که واکسن را دریافت کرده بودند اتفاق افتاده بود. در ۱۰۰ درصد افرادی که سه دز واکسن را دریافت کرده بودند، آنتی بادیهای خنثی کننده دیده شد.
در رژیم سه دزه، اثربخشی واکسن در پیشگیری از فرمهای علامتدار بیماری حدود ۶۵ درصد و در پیشگیری از بستری و فرمهای شدید بیماری حدود ۹۷ درصد به دست آمد، که عدد بسیار قابل اطمینان و مناسبی است.
خوشبختانه عوارض جدی منتسب به واکسن درباره هیچ یک از سه دز تزریقی این واکسن گزارش نشد. عوارضی هم که گزارش شد، اکثرا خفیف بود. شایعترین عارضه متعاقب تزریق دز اول، درد محل تزریق بود که در حدود ۳۸ درصد داوطلبین مشاهده شد. بی حالی عمومی، سردرد و تب عوارض دیگری بود که گزارش شد. در تزریق دز دوم و سوم واکسن عوارض باز هم خفیفتر شد.
یک کمیته عالی پایش و ایمنی داده، متشکل از ۸ متخصص از رشتههای مختلف و نمایندگان سازمان غذا و دارو، مرکز مدیریت بیماریهای واگیر و کمیته ملی اخلاق در پژوهشهای علوم زیستی کشور، بر حسن انجام مطالعه و نتایج آن نظارت داشتند.
لازم است فرصت را غنیمت بشمارم و از حمایت همه افرادی که برای انجام مطلوب این مطالعه کمک کردند، و به طور خاص کارکنان و مدیران دلسوز ۸ دانشگاه علوم پزشکی مطالعه، و داوطلبان مطالعه، تشکر نمایم.
کارایی واکسن در کودکان
در این مدت، مطالعه کارآزمایی بالینی این واکسن در کودکان هم انجام شد. نتایج این مطالعات، که منتشر شده است، نشان داده که بعد از تزریق دو دُز واکسن، افزایش چهار برابری تیتر آنتیبادی در ۹۹ درصد کودکان ۳ تا ۱۱ سال و ۹۳ درصد در کودکان ۱۲ تا ۱۸ سال وجود داشته است. بر این اساس مجوز تزریق واکسن در کودکان بالای ۵ سال هم برای این واکسن در کشور صادر شد.
استمرار کارایی این واکسن در برابر واریانت اومیکرون
هر مطالعه آزمایشگاهی از کارایی واکسنها در برابر واریانتهای جدید، برای ارزیابی درست، نیاز به تایید در سطح جامعه نیز دارد. خوشبختانه در ۲ مطالعه منتشر شده این واکسن، تیتر آنتی بادی خنثی سازی قابل قبول در برابر واریانت اومیکرون هم نشان داده شد. علاوه بر این، در مطالعه در سطح جمعیت، کارایی با محافظت قوی و بادوام این واکسن در افراد واکسینه شده در برابر بیماریهای علامت دار و شدید ناشی از امیکرون نشان داده شده است.
پاستوکووک؛ دُز یادآور واکسنهای کشور
با توجه به ظهور واریانت¬های جدید واکسن گریز و وجود شواهدی مبنی بر افت تدریجی سطح ایمنی حاصل از واکسیناسیون کووید۱۹، تزریق دز یادآور بعد از چند ماه، بویژه برای واکسنهای مبتنی بر زیرساخت (پلتفرم) ویروس غیرفعال، حائز اهمیت است. خوشبختانه، نتایج مطالعات در انستیتو پاستور ایران نشان داد که واکسن¬ پاستوکووک، می¬تواند نقش مهمی در ادامه برنامه واکسیناسیون علیه این بیماری در کشور داشته باشد. تحقیقات همچنین نشان داده است که تزریق واکسنهای مربوط به دو زیرساخت متفاوت، باعث ایجاد ایمنی موثرتر و پایدارتر علیه ویروس عامل کووید۱۹ میشود.
با توجه به مطالعات انجام شده تکمیلی در انستیتو پاستور ایران، واکسن پاستوکووک از اوایل تیر ماه ۱۴۰۱ به عنوان دُز یادآور اول و دوم تمام واکسنهای استفاده شده در کشور، مورد تایید سازمان غذا و دارو قرار گرفت و در مراکز واکسیناسیون سراسر کشور مورد استفاده قرار گرفت.
در مطالعاتی که در کشور انجام شده، نشان داده شده است که میانگین آنتیبادی متعاقب دریافت دُز یادآور واکسن پاستوکووک، در گیرندگان دو دُز اولیه واکسن سینوفارم، بیش از ۲۰ برابر افرادی بوده است که دُز یادآور سینوفارم را دریافت کرده بودند. در این مطالعه، درصد سروکانورژن (افزایش ۴ برابری آنتیبادی نسبت به مقدار پایه) آنتیبادی در گیرندگان دُز یادآور پاستوکووک هم بیش از ۳ برابر گروه دریافتکننده واکسن سینوفارم بود. در مطالعه دیگری که بر روی داوطلبین گیرنده دو دُز اولیه واکسن آسترازنکا انجام شده است، نیز نشان داده شد که میزان افزایش تیتر آنتی بادی درگروه دریافت کننده واکسن کووید-۱۹ تولیدی انستیتو پاستور ایران بیش از دو برابر گروه دریافت کننده واکسن آسترازنکا است.
همچنین، نتایج ارزیابی پایداری ایمنی حاصل در افرادی که ۳ دُز از واکسنهای تولیدی انستیتو پاستور ایران را دریافت کرده بودند، نشان داده است که شش ماه بعد از تزریق دُز سوم، کماکان پاسخ ایمنی قابل قبولی در افراد دریافت کننده حفظ شده بود.
این مطالعات نشان داده است که کارایی واکسنهای کووید-۱۹ تولید مشترک انستیتو پاستور ایران و انستیتو فینلای کوبا به عنوان دُز یادآور، در تحریک سیستم ایمنی به صورت معناداری، بالاتر از واکسنهای سینوفارم و آسترازنکا است. در این مطالعات همچنین مشخص شده که کارایی دُز یادآور واکسنهای پاستوکووک و پاستوکووک-پلاس، مشابه یکدیگر بوده و عوارض جانبی خاصی نیز متعاقب تزریق آنها گزارش نشد.
انتقال دانش فنی تولید واکسن پاستوکووک
انستیتو پاستور ایران قرارداد انتقال تکنولوژی ساخت واکسن پنوموکوک را با انستیتو فینلای کوبا چند سال پیش منعقد کرده بود. در روند اجرای این قرارداد و با شروع پاندمی کووید ۱۹ و از آنجا که تکنولوژی ساخت این واکسن با واکسن کووید-۱۹ (سوبرانا، پاستوکووک) در مرحله کونژوگاسیون پروتئین استفاده شده در واکسن مشابه بود، انستیتو پاستور ایران قرارداد جدیدی برای انتقال تکنولوژی ساخت واکسن پاستوکووک منعقد نکرد و به صورت متمم قرارداد پنوموکوک کار را با طرف کوبایی پیش برد. در عین حال برای اولین بار خط تولید این محصول از سلولهای نوترکیب جانوری توسعه یافت و با نصب و راه اندازی دو بیوراکتور ۵۰۰ لیتری و کسب مهارتهای لازم، اخذ دانش فنی کونژوگه کردن و فرمولاسیون به انستیتو پاستور ایران منتقل شد.
تاکنون بیش از ۱۶ میلیون دز از این واکسن تولید و توزیع شده است و این آمادگی وجود دارد که در صورت اعلام نیاز وزارت بهداشت، مقدار بیشتری از این واکسن تولید و در اختیار مجموعه بهداشتی کشور قرار گیرد.
محققان انستیتو پاستور ایران با تمام توان و براساس استاندارهای بالا تلاش کردند که در این مدت، نگرانی مردم را با در دسترس قرار دادن یک واکسن اثربخش و بی خطر کم کنند. این افتخاری برای انستیتو پاستور ایران است که با همکاری انستیتو فینلای کوبا، چنین واکسنی را تقدیم ملت ایران نموده است. در این مدت، پیشینه بیش از یکصد سال فعالیت انستیتو پاستور ایران در حوزه تولید واکسنهای مختلف، آرامش و خاطر امنی را برای مردم ایجاد کرد که با خیال راحت بتوانند از این واکسن و واکسنهای مشابه تولیدی این انستیتو استفاده کنند و امیدواریم که بتوانیم همچنان در راه خدمت به مردم عزیر کشورمان گام برداریم.
لینک مقاله
https://jamanetwork.com/journals/jamanetworkopen/fullarticle/۲۸۰۴۴۵۲?utm_campaign=articlePDF&utm_medium=articlePDFlink&utm_source=articlePDF&utm_content=jamanetworkopen.۲۰۲۳.۱۰۳۰۲
منبع خبر: خبرگزاری دانشجو ![]()
اخبار مرتبط: انتشار مطالعه فاز سوم کارآزمایی بالینی واکسن پاستوکووک انستیتو پاستور
حق کپی © ۲۰۰۱-۲۰۲۴ - Sarkhat.com - درباره سرخط - آرشیو اخبار - جدول لیگ برتر ایران